В 1723 г. врач из Люцерна Мориц Антон Капеллер, пожалуй, впервые придал термину «кристалл» более широкое значение. А еще раньше, в 1669 г., датчанин Нильс Стенсен в своем труде «Dissertationis Prodromus» показал, что у кварца всегда появляются одни и те же определенные воды граней, характерные именно для него, причем углы между ними всеща одинаковы (закон постоянства углов). Позже выяснилось, что эти наблюдения над кристаллами кварца имеют общее значение для любых кристаллов.
Как же возникают грани кристалла и как вообще растет кристалл?.
Соединение, хорошо нам известное как вода (молекула Н
0,. состоящая из элементов водорода и кислорода в отношении 2:1), в зависимости от температуры может находиться в твердом (лед), жидком (вода) или газообразном (пар) фазовом состоянии. В твердом состоянии молекулы воды сцеплены между собой, образуя типичную кристаллическую решетку.
С повышением температуры происходит ослабление сил взаимного сцепления координационных связей, которое при 0°С заходит настолько далеко, что наступает распад кристаллической решетки. Высвобождающиеся из нее молекулы образуют новые, теперь уже свободно движущиеся по отношению друг к другу комбинации, при этом соединение переходит в жидкое состояние (воду). Этот процесс называется таянием (в общем случае — плавлением).
При охлаждении воды до точки замерзания стремление атомов к взаимной координации, наоборот, возрастает. Вначале происходит объединение небольшого числа отдельных частиц с образованием зародыша кристалла, который затем путем медленного наращивания снова образует решетку. По завершении этого процесса последнюю опять можно представить как упорядоченную атомную постройку — кристаллическую решетку. Необходимо подчеркнуть, что кристаллическая решетка возникает путем постепенного присоединения атомов. Это и называется ростом кристаллической решетки.
Подобным же образом можно описать рост кристаллов соли из водного раствора (в общем случае — из расплава). Принципиально важно отметить, что растущая кристаллическая решетка стремится окружить себя плоскими атомными сетками, которые воспринимаются глазом как грани кристалла. Свободный беспрепятственный рост кристалла благоприятствует появлению на нем граней. В природе, однако, часто возникает обстановка стесненного роста, обусловленная недостатком свободного объема, помехами со стороны соседних кристаллов и подобными этим явлениями. В результате могут образоваться зерна, имеющие совершенно неправильные внешние контуры. Хотя они и выглядят внешне как совершенно неупорядоченные образования, их внутреннее кристаллическое строение в большинстве случаев полностью сохраняется и может быть выявлено с помощью рентгеновских лучей.
Идеальный кристалл образуется в обстановке полного соответствия условий возникновения и роста. Однако большинство встречающихся в природе кристаллов обнаруживает небольшие отклонения от вдеальной формы — искажения. Эти кристаллы с искаженными формами именуют реальными кристаллами.
При описании форм кристаллов в целом различают простые формы и их комбинации. Простая форма представлена в том случае, когда все грани кристалла одинаковы, равнозначны; если же они различны, то есть принадлежат разным простым формам, говорят о комбинации.
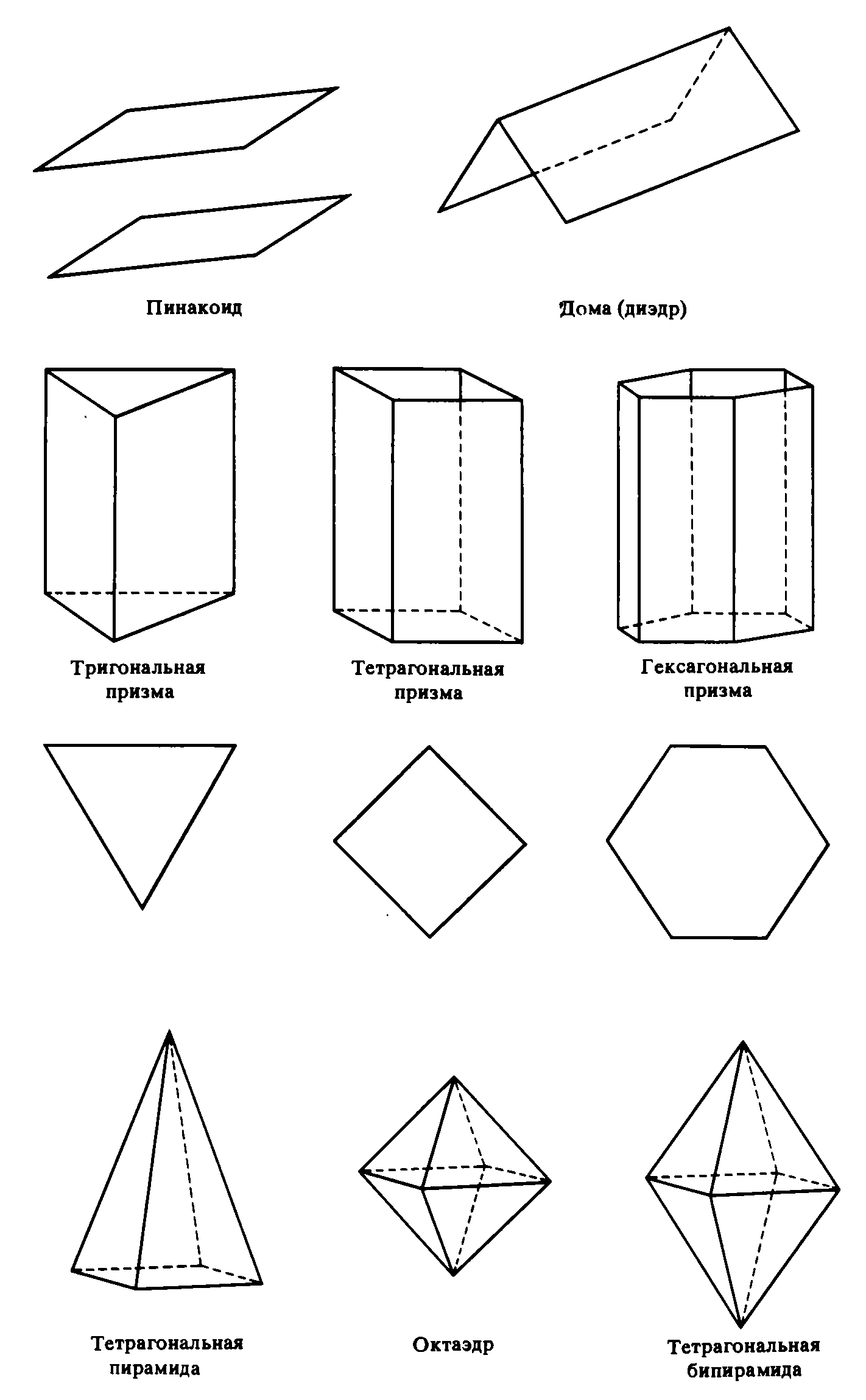
Простые формы можно подразделить на замкнутые простые формы, которые могут существовать сами по себе (всего их у кристаллов в соответствии с законами симметрии только 30), и открытые простые формы, которые возможны лишь в комбинациях.
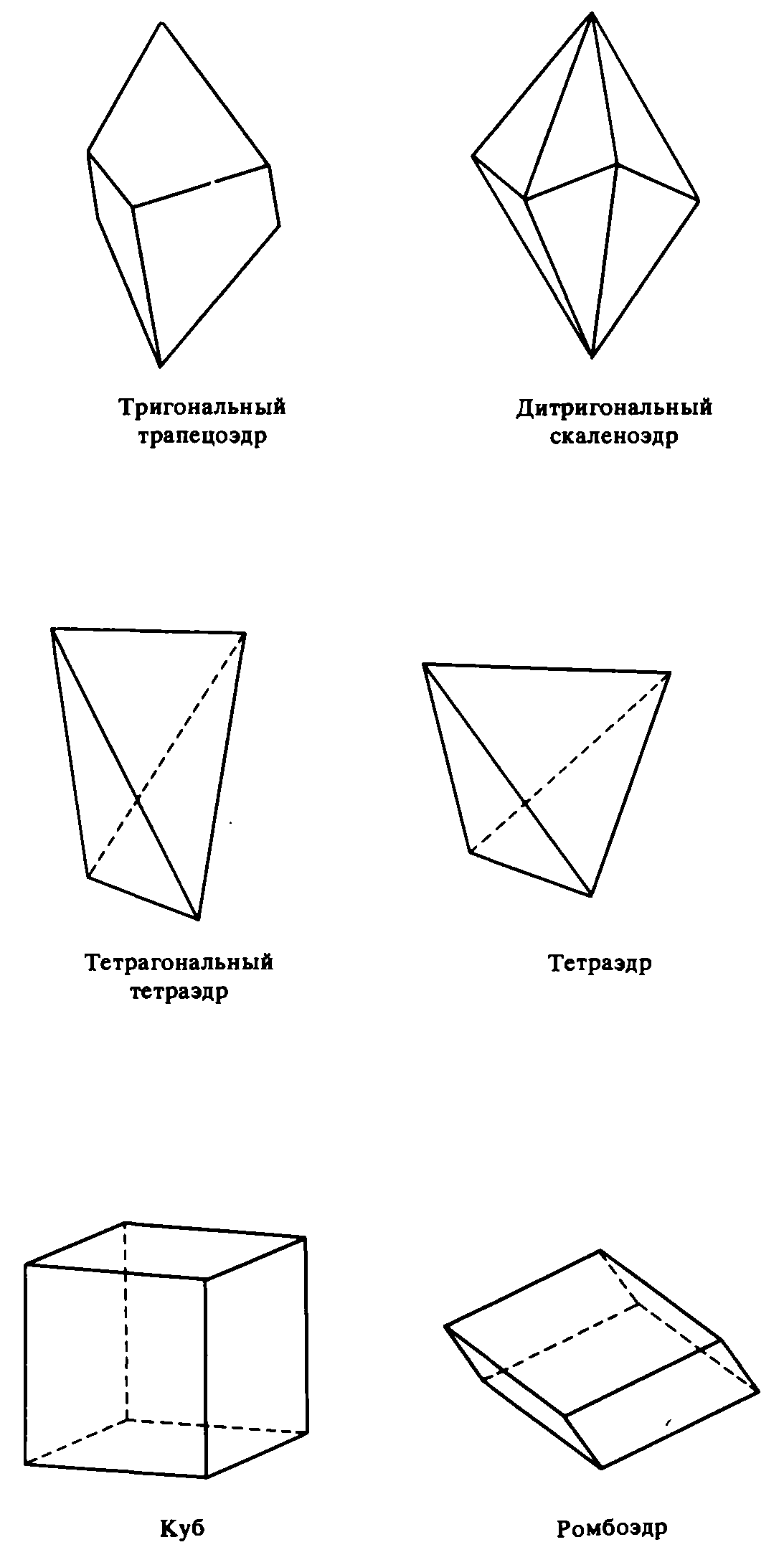
Если присутствует одна-единственная открытая простая форма, не имеющая другой себе эквивалентной, то говорят о моноэдре (педионе). Если же моноэдр имеет параллельную ему противолежащую грань, то такая открытая простая форма называется пинакоидом, а если другая равнозначная плоскость не параллельна, а располагается под углом к первой, то такая форма носит название домы (из-за своего сходства с двускатной крышей), или диэдра. Когда две равнозначные плоскости сходятся в форме клина, образуется сфеноид (осевой диэдр, полупризма). При наличии нескольких равнозначных плоскостей, пересекающихся по параллельным ребрам, возникают различные призмы: трехсторонняя (тригональная), четырехсторонняя квадратная (тетрагональная), четырехсторонняя прямоугольная (ромбическая) и шестисторонняя (гексагональная).
Пирамиды — открытые формы, образованные несколькими равнозначными плоскостями, ребра которых сходятся в одной точке. Особые разновидности пирамид носят те же названия, что и соответствующие призмы.
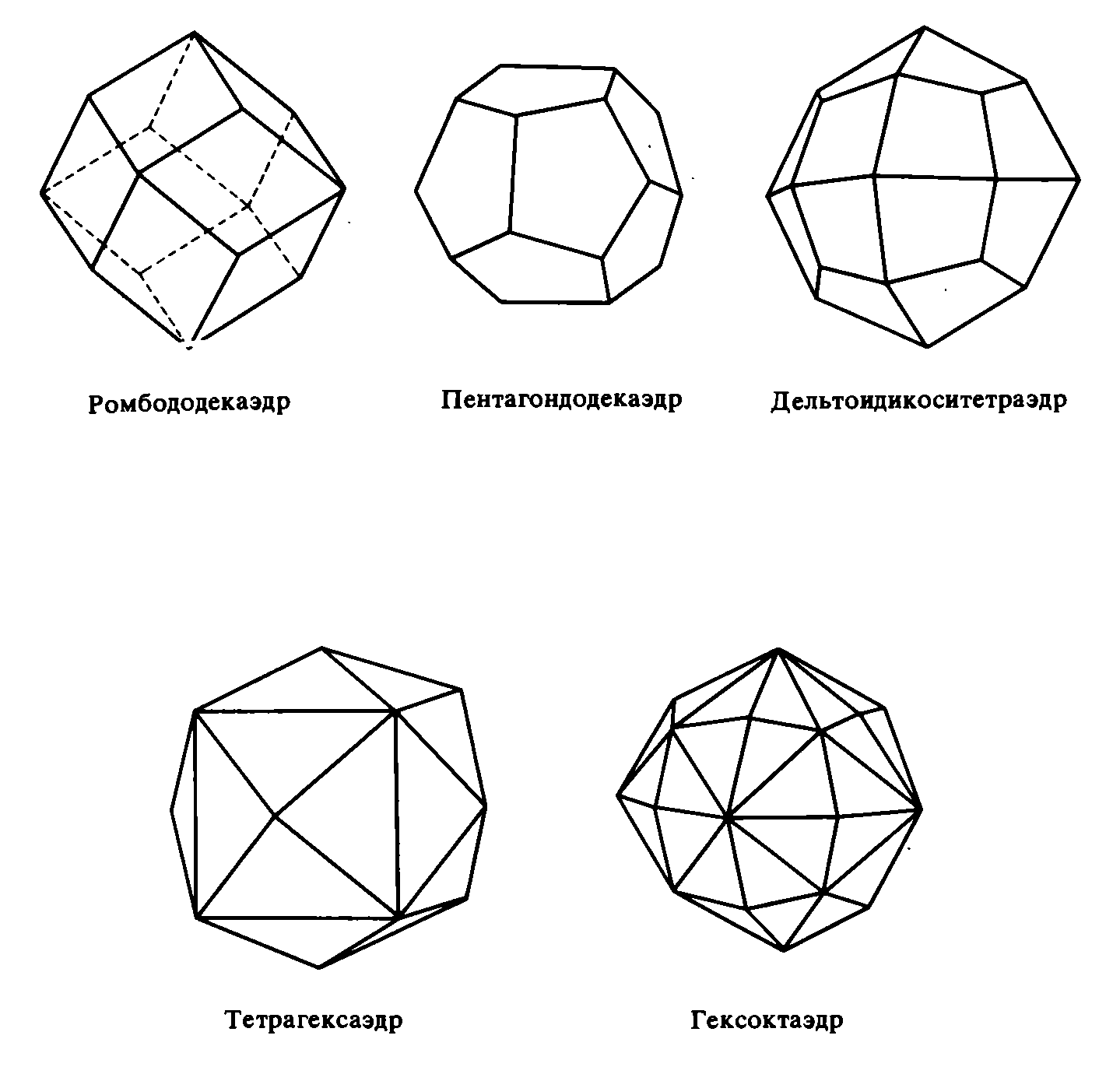
К закрытым простым формам относятся бипирамида, октаэдр, трапецоэдр, скаленоэдру бисфеноид (ромбический и тетрагональный тетраэдры), тетраэдр, куб (гексаэдр)I, ромбоэдр, ромбододекаэдр, пентагондодекаэдр, икоситетраэдр (тетрагонтриктаэдр), тетрагексаэдр и гексаоктаэдр.
Поскольку открытые формы не могут существовать сами по себе, самостоятельно, они прежде всего образуют комбинации. Однако и закрытые формы сплошь и рядом встречаются в комбинациях. Среди простых форм комбинации чаще всего образуют призма и пина ко ид, пирамида и моноэдр. Нередко совместно встречаются призма и бипирамида, иноща также куб и октаэдр.
При рассмотрении всех этих кристаллографических форм ясно видно, что каждая из них имеет определенную симметрию, степень которой оценивается; исходя из отдельных ее элементов. В числе этих элементов следует назвать: плоскости зеркального отражения (плоскости симметрии), оси симметрии и центр симметрии. На основании возможных сочетаний различных элементов симметрии формы кристаллов можно подразделить на кристаллографические системы (сингонии) и классы симметрии.
Самой высокой симметрией характеризуется кубическая сингония, к которой принадлежат куб, октаэдр, ромбододекаэдр и другие формы. Из драгоценных и цветных камней в этой сингонии кристаллизуются алмаз, гранат, флюорит, сфалерит.
Далее по симметрии выделяются: тетрагональная сингония— циркон; гексагональная— апатит, берилл; тригональная (частично относимая к гексагональной) — турмалин, корунд; ромбическая — топаз; моноклинная — ортоклаз; триклинная — лабрадор. Здесь названы лишь некоторые представители отдельных сингоний. Кристаллы триклинной сингонии характеризуются самой низкой симметрией.
До сих пор, говоря о кристаллах и их формах, мы имели в виду только отдельные индивидуумы, одиночные кристаллы. Однако в природе они встречаются крайне редко. Сочетание немногих хорошо развитых связанных между собой кристаллов называется срастанием (сростком) кристаллов. Но гораздо чаще встречаются срастания многих кристаллов, нередко несовершенной формы, называемые кристаллическим агрегатом.
В некоторых срастаниях кристаллов устанавливаются закономерные отношения между их гранями и кристаллическими индивидами. Примером такого срастания
может служить параллельное срастание, в котором равнозначные грани разных индивидуумов ориентированы параллельно.
Когда два кристалла срастаются по общей плоскости таким образом, что каждый из них является как бы зеркальным отражением другого, то говорят о двойниковании, или двойниковом срастании (контактные двойники). Двойниковые прорастания представляют собой кристаллы, в двойниковом положении проросшие друг друга. В двойниковании могут участвовать больше чем два индивидуума. Тогда говорят о тройниках, нетверниках, множественных двойниковых сростках.
Среди кристаллических агрегатов также можно выделить различные их виды — как неориентированные, так и ориентированные. В качестве примера ориентированных агрегатов можно назвать субпараллельные и радиальные, радиальноволокнистые, веерообразные, сталактитовые и оолитовые агрегаты.
ХИМИЧЕСКИЕ СВОЙСТВА.
Химические свойства драгоценных камней мы здесь подробно рассматривать не будем. Они представлены в таблицах, помещенных в конце книги и содержащих данные о химическом составе этих минералов.